鳞状细胞癌(以下简称“鳞癌”)是一种常见的侵袭性恶性肿瘤,目前临床治疗仍缺少有效的靶向治疗方法。近年来,免疫疗法特别是靶向PD-1/PD-L1通路的免疫检查点阻断(ICB)疗法已在鳞癌患者中取得了显著的疗效。然而,仅有少数鳞癌患者(~20-40%)从中受益。特别是,表现为“免疫冷”表型的患者对ICB疗法不响应或复发。因此,对鳞癌免疫逃逸机制的深入理解,将有助于开发免疫疗效响应性分子标志物和潜在的免疫治疗增效策略。
近日,中国科学院合肥物质科学研究院健康所蒋焱熠团队与南加州大学De-Chen Lin团队合作在Nature Communications发表了题为“Reciprocal inhibition between TP63 and STAT1 regulates anti-tumor immune response through interferon-γ signaling in squamous cancer”的研究论文。该研究揭示了鳞癌的主转录因子TP63通过抑制IFNγ-STAT1信号通路而促进肿瘤发生免疫逃逸。在小鼠体内模型中,下调TP63表达显著增强了PD-1抗体的抗肿瘤免疫疗效。

研究人员首先通过鳞癌患者样本、细胞系和TP63敲降后的转录组数据分析,均发现TP63的表达抑制了干扰素-γ/α(IFNγ/α)等免疫响应信号通路。进而利用同种系小鼠移植瘤模型结合scRNA-seq测序分析和体外共培养等实验发现,敲降TP63导致CD8+ T细胞浸润增加并增强其肿瘤杀伤能力。同时,在鳞癌患者中,TP63的表达也与CD8+ T细胞的浸润和活化呈负相关性。更重要的是,下调TP63的表达可显著增强 PD-1 抗体的抗肿瘤免疫治疗疗效。机制方面,研究人员通过单细胞转录组、表观遗传修饰和生化分子实验等揭示,TP63与STAT1呈现出相互拮抗的调控模式,通过共占据和共调节各自的启动子和增强子在转录水平相互抑制,二者的相对表达量作为 IFNγ信号通路的分子开关,调节下游干扰素刺激基因的表达和CD8+ T细胞活性而决定鳞癌肿瘤的免疫响应。
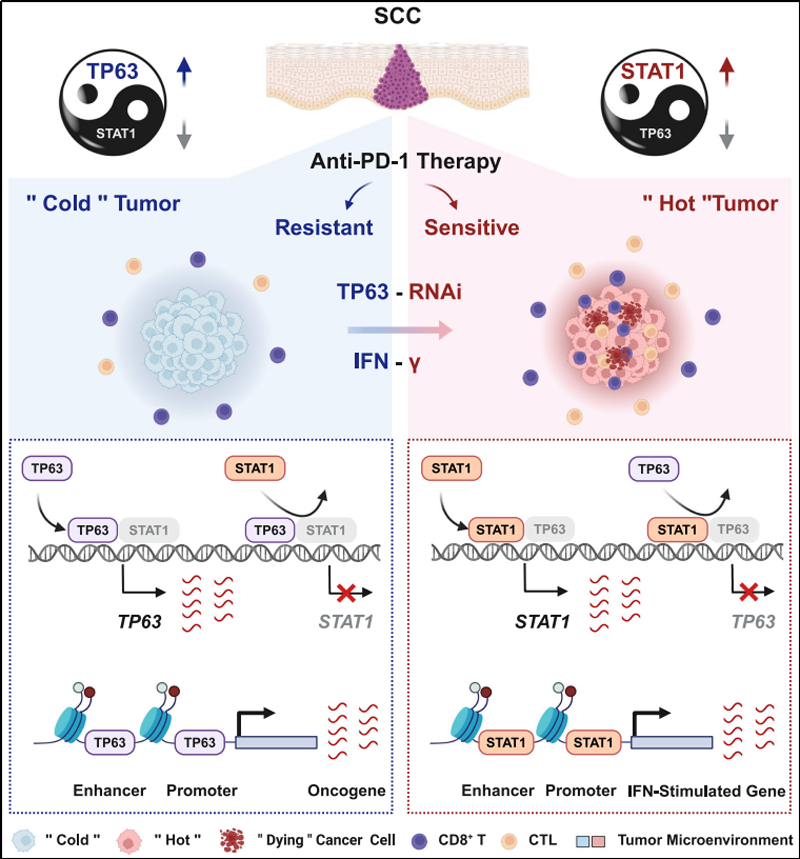
TP63抑制鳞癌免疫应答的模式图
综上,该研究揭示了TP63在促进鳞癌细胞免疫逃逸中的重要作用。TP63的表达或许可以作为预测鳞癌ICB免疫治疗疗效的分子标志物,抑制TP63可能是将“免疫冷”鳞癌肿瘤转变为“免疫热”肿瘤的潜在分子途径。靶向TP63/STAT1/IFNγ轴可能增强鳞癌患者的ICB免疫治疗疗效。
中国科学院合肥物质院副研究员蒋远、中山大学附属第七医院副研究员郑悦媛、中国科学院合肥物质院项目研究员张远伟和博士生孔帅为论文的并列第一作者;中国科学院合肥物质院研究员蒋焱熠和南加州大学终身助理教授De-Chen Lin为该论文的并列通讯作者。锡达尔西奈医学中心的H. Phillip Koeffler教授和北京协和医学院肿瘤医院王明荣教授团队为本研究做出了重要贡献。该项研究得到了国家自然科学基金、安徽省自然科学基金、分子肿瘤学国家重点实验室开放课题、DeGregorio Family Foundation和合肥物质院院长基金的支持。
原文链接:https://doi.org/10.1038/s41467-024-46785-9











