近期,中科院合肥研究院健康所(中国科学院合肥肿瘤医院一体化发展单位)刘青松药学团队研发出一种新型不可逆EZH2抑制剂IHMT-337,能够通过降解EZH2蛋白起到抑制恶性肿瘤的作用,该研究成果发表于国际期刊Signal Transduction and Targeted Therapy。
果蝇Zeste基因增强子人类同源物2(EZH2)是多梳蛋白家族(PcG)中关键成员之一, 也是多梳抑制性复合物2(PRC2)中具有催化活性的亚单位, 具有组蛋白甲基化转移酶活性, 在表观遗传修饰过程中扮演重要角色。研究表明,EZH2与恶性肿瘤的发生发展有着十分密切的关系。与正常组织相比,肿瘤组织中往往发生EZH2表达的上调,且其表达水平与肿瘤的恶性程度呈正相关。在乳腺癌、淋巴瘤等恶性肿瘤中,EZH2的表达水平改变较为显著。除了上述经典的甲基转移酶活性外,EZH2还通过非组蛋白途径和不依赖PRC2复合体家族的转录调控途径参与肿瘤的发生发展。目前已获批上市和处于临床研究的EZH2抑制剂主要围绕抑制其甲基转移酶活性进行开发,导致其药效有限或容易产生耐药等临床问题。因此,诱导EZH2降解成为解决上述问题的一种新策略。
在本研究中,科研团队采用理性设计的药物研发策略,发展了一种新型不可逆EZH2抑制剂IHMT-337。该化合物与EZH2在Cys663处共价结合,并通过E3连接酶chip介导的泛素化降解途径降解EZH2。进一步的机制研究发现,EZH2能够直接作用于CDK4的启动子从而转录调控CDK4的表达,CDK4的转录抑制直接影响三阴性乳腺癌细胞的细胞周期,使三阴性乳腺癌细胞的增殖被抑制。CDK4被EZH2转录调控是一种新的与PRC2复合物甲基转移酶活性无关的功能。更重要的是,该化合物在体外和体内的不同临床前模型中都抑制了弥漫性大B细胞淋巴瘤和三阴性乳腺癌细胞的增殖和肿瘤的生长,显示出临床应用方面的潜力。这些研究结果表明,除了甲基转移酶活性抑制外,IHMT-337降解EZH2可能是一种潜在的治疗三阴性乳腺癌和其他不依赖于EZH2酶活性的恶性肿瘤的策略。
该研究工作获得了国家自然科学基金、中科院前沿科学重点研究计划和中科院青促会等项目的支持。
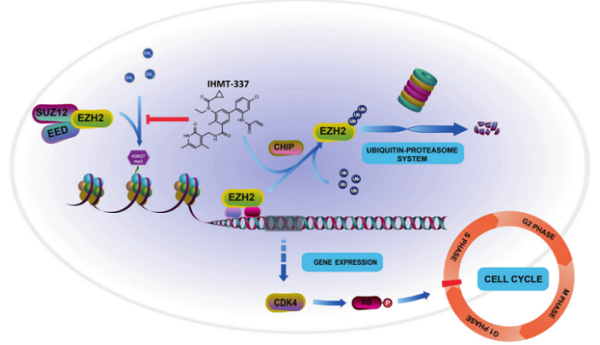
IHMT-337通过靶向CDK4的转录调控影响细胞周期进程示意图











