铁死亡是一种由脂质过氧化驱动的、铁依赖性的程序性细胞死亡方式,与多种恶性肿瘤的发展和治疗响应密切相关。2025年1月25日,中国科学院合肥物质科学研究院健康所(中国科学院合肥肿瘤医院)蒋焱熠团队在癌症研究经典期刊Oncogene上发表了题为“Targeting aldehyde dehydrogenase ALDH3A1 increases ferroptosis vulnerability in squamous cancer”的研究论文。该研究揭示了鳞状细胞癌(SCC)内异常高表达的醛脱氢酶ALDH3A1,通过抵抗铁死亡而促进肿瘤细胞的恶性表型。皮下成瘤和类器官模型同时验证了ALDH3A1的抑制剂EN40联合铁死亡诱导剂RSL3具有较强的协同杀伤肿瘤的效果。
研究人员首先通过TCGA来源的鳞癌患者样本、鳞癌细胞系和ALDH3A1敲降后的鳞癌细胞非靶向代谢组数据分析,均发现ALDH3A1的高表达与抗铁死亡相关的信号通路呈现正相关性,分子生物学实验证明ALDH3A1通过代谢毒性醛的方式降低细胞内的脂质过氧化水平发挥抗铁死亡作用。同时,利用裸鼠移植瘤模型结合鳞癌类器官模型等实验发现,敲降或EN40联合铁死亡诱导剂具有协同杀伤肿瘤的能力。机制方面,研究人员通过表观遗传修饰和生化分子实验分析,发现鳞癌驱动性转录因子TP63直接结合在ALDH3A1的超级增强子和启动子区促进其转录活性。更有意思的是,敲降TP63的细胞中过表达ALDH3A1能够回复因TP63下调引起的脂质过氧化增加,提示鳞癌细胞利用其驱动性转录因子TP63上调ALDH3A1以抵抗细胞内脂质过氧化介导的铁死亡过程。
综上,该研究揭示了ALDH3A1在促进鳞癌细胞恶性表型中的具体作用。ALDH3A1的表达或许可以作为鳞癌的分子标志物,靶向ALDH3A1联合铁死亡诱导剂可能改善鳞癌患者的临床预后。
中国科学院合肥物质院健康所博士生孔帅、安徽医科大学第一附属医院胸外科副主任医师潘华光和中国科学院合肥物质院项目研究员张远伟为论文的并列第一作者;中国科学院合肥物质院研究员蒋焱熠、蒋远和上海市肿瘤研究所研究员王博石为该论文的并列通讯作者。该项研究得到了国家自然科学基金、中国科学院C类先导专项、安徽省自然科学基金和合肥物质院院长基金的支持。
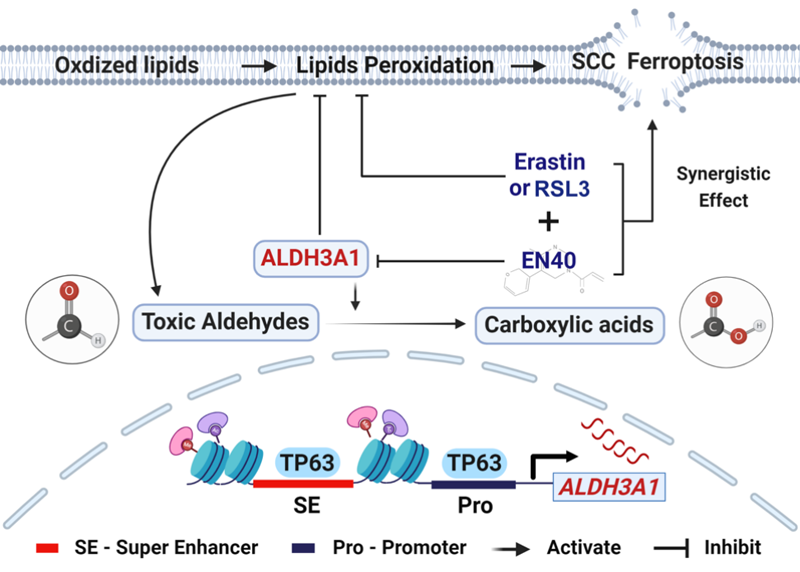
ALDH3A1调控鳞癌细胞抵抗铁死亡的模式图











