近期,中国科学院合肥肿瘤医院辐射生物医学研究室(韩伟团队)在低温等离子体肿瘤治疗方面再次取得重要突破,首次报导大气压低温等离子体可有效诱导肿瘤细胞发生焦亡(Pyroptosis)。相关论文“Cold Atmospheric Plasma Induces GSDME-Dependent Pyroptotic Signaling Pathway via ROS Generation in Tumor Cells”发表于Cell Death & Disease上。该期刊系Nature出版集团旗下的医学生命科学期刊之一,主要关注细胞死亡和转化医学研究等领域的原创性研究。
等离子体医学近年来蓬勃发展,等离子体肿瘤治疗被视为一种新兴的肿瘤治疗方式。以往大量研究表明,等离子体通过诱导肿瘤细胞发生典型凋亡或坏死等形式的细胞死亡,达到抑制肿瘤生长及“清除”肿瘤的效果。细胞焦亡是一种炎性细胞程序性死亡,以往细胞焦亡研究多集中于机体固有免疫。2017年,邵峰院士首次发现化疗药物可导致肿瘤细胞发生GSDME介导的焦亡,不同于凋亡,肿瘤细胞的焦亡发生更为快速,容易激活体内免疫系统。
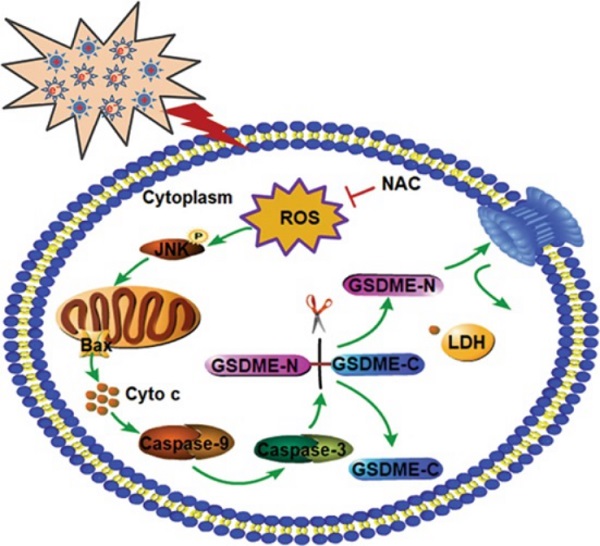
该研究通过筛查三个瘤种共计十五株肿瘤细胞系,发现等离子体对肿瘤细胞的杀伤效果与细胞内GSDME的表达水平呈正相关;相关分子机制研究表明,等离子体通过激活ROS/JNK/Cytochrome C/Caspse-9/Caspse-3信号通路,进一步切割GSDME,导致肿瘤细胞发生焦亡型细胞死亡。
该研究不仅首次报导了等离子体致死肿瘤细胞的新型死亡方式——焦亡,也是首次报导物理治疗方法可导致肿瘤细胞发生焦亡。研究结果进一步增加了对等离子体肿瘤治疗机制的深入了解,为凋亡抵抗型肿瘤提供了一种新的治疗策略;
该研究工作由辐射生物医学研究室杨小枘(2019届硕士)和陈国栋(助理研究员)共同完成。研究得到国家重点研发计划(2019YFC 0119000)、安徽省自然科学基金(1608085QH181)资助。
文章链接:https://www.nature.com/articles/s41419-020-2459-3