近日,中国科学院合肥物质院健康所(中国科学院合肥肿瘤医院)基因组学团队张帆研究员与哈尔滨工业大学生命科学和医学学部黄志伟教授团队在《Science Bulletin》期刊在线发表了题为“The core cellular network modulates immune phenotype switching in hepatitis B”的研究论文。该研究深入探讨了乙型肝炎病毒(HBV)不同临床发展阶段免疫表型动态转变的细胞和分子调控网络(图1),为慢性乙型肝炎的免疫治疗策略提供了重要理论依据。
乙型肝炎病毒(HBV)感染是全球肝病相关发病和死亡的主要病因之一。绝大多数成人感染HBV后可发展为急性感染(AHB)且常能自愈,但婴幼儿和儿童往往发展为慢性乙肝(CHB),病程高度异质,通常分为免疫耐受期(IT)、免疫活跃期(IA)和非活跃慢性感染期(ICI)。尽管已有研究揭示了乙肝免疫反应的某些机制,但乙型肝炎不同临床阶段的免疫表型转变过程尚不明确。因此,该研究对乙肝感染不同临床阶段的18名肝炎患者和3名健康对照个体的肝脏活检样本和外周血单核细胞样本进行了单细胞RNA、TCR/BCR测序,旨在探讨不同阶段的免疫特征及其对疾病治疗的启示。
该研究系统描绘了乙型肝炎不同发展阶段肝内及外周的单细胞图谱,阐明了CD8+T细胞亚群分化与功能状态在乙型肝炎中的作用、DC-SIGN+巨噬细胞的双重免疫表型与免疫抑制环境、HBV感染中肝细胞亚型差异与免疫耐受机制及免疫活跃期(IA)体液免疫应答与中性粒细胞的免疫调节作用等关键机制。为开发靶向免疫抑制(如PD-1/IL-10通路)或增强细胞毒性(如IL-2疗法)的新型治疗策略提供了科学依据。
1. CD8+T细胞亚群分化与功能状态在乙型肝炎中的作用
研究发现,肝组织内CD8+T细胞可分为GZMK+(具有FasL/Fas通路介导的细胞毒性)和GZMB+(具有GZMB-perforin通路介导的细胞毒性)两大亚群,其中GZMK+T细胞在AHB和IA阶段显著扩增,并通过FasL/Fas介导的细胞毒性参与免疫应答。拟时序分析揭示了外周血浸润到肝组织的T细胞(hpCTLs)的三类状态:早期分化态(State1,GZMB+PRF1+ CTLs)、短寿命效应态(State2:KLRG1+ CTLs)和耗竭态(State3:GZMK+PDCD1+ CTLs),其中State3在IA阶段占比最高(68.8%),提示耗竭表型与疾病进展相关。研究揭示了GZMK+和GZMB+ hpCTLs在乙型肝炎病毒清除或持续感染中的潜在作用,并发现FasL/Fas介导的细胞毒性、CD28共刺激以及耗竭状态可能是决定hpCTLs病毒清除功能的关键因素。
2. DC-SIGN+巨噬细胞的双重免疫表型与免疫抑制环境
研究发现肝内常驻的DC-SIGN+巨噬细胞在乙型肝炎免疫反应中的双重免疫表型。这些巨噬细胞既可以作为抗原呈递细胞(APC)通过响应IL-2刺激交叉激活T细胞,促进肝内免疫激活,也可以通过分泌IL-10和表达PD-L1抑制T细胞免疫,并通过CCL18-CCR8互作促进Treg细胞招募。DC-SIGN+巨噬细胞与其他细胞成分(如CSF1+ST2+肥大细胞、IL-33+肝窦内皮细胞和Treg细胞)共同构筑了肝内IA期的type 2免疫抑制环境。
3. HBV感染中肝细胞亚型差异与免疫耐受机制
研究还发现,中央静脉周围Hep1和门静脉周围Hep2两类肝细胞对HBV感染和先天免疫反应的敏感性不同,门静脉周围肝细胞(Hep2)高表达HBV受体NTCP,感染率显著高于中央静脉周围肝细胞(Hep1)(IT期:67% vs. 10.3%)。HBV感染的Hep2细胞通过下调共刺激分子(如CD80/CD86)导致T细胞功能缺陷,可能与IT阶段的免疫耐受相关。
4. 免疫活跃期(IA)体液免疫应答与中性粒细胞的免疫调节作用
IA阶段患者表现出强烈的体液免疫应答, 浆细胞和IgG1抗体水平显著升高,这可能与滤泡辅助性T细胞(Tfh)分泌的IL-21密切相关。 空间转录组分析显示,中性粒细胞通过CXCR2-CXCL2/3/6/8轴在AHB和IA阶段富集,并且通过前列腺素PGE2-EP4信号通路来抑制T细胞功能从而加剧IA阶段的免疫损伤。
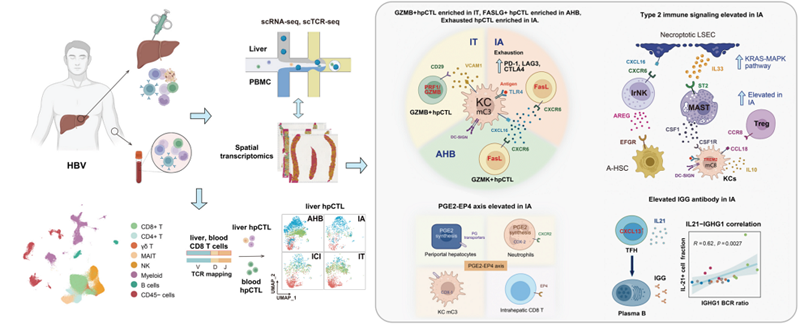
图1 实验设计和乙肝不同临床分期的细胞免疫表型及分子机制解析图
该论文的通讯作者是健康所张帆研究员和哈尔滨工业大学黄志伟教授。该工作由腾讯基金会科学探索奖和新基石科学基金会资助。











