近日,中国科学院合肥物质院健康所(中国科学院合肥肿瘤医院)谷红仓基因组学团队联合浙江大学第二附属医院神经外科在国际医学期刊《BMC Medicine》上发表了题为“Molecular signatures of invasive and non-invasive pituitary adenomas: a comprehensive analysis of DNA methylation and gene expression”的研究论文。本研究通过整合肿瘤组织和血浆样本的RRBS与RNA-seq数据,系统绘制了侵袭性与非侵袭性垂体腺瘤的表观遗传学图谱。研究发现17个甲基化异常且表达变化显著的关键基因,并构建了以MIR4535、SLC8A1-AS1和TTC34为核心的细胞游离DNA(cfDNA)甲基化标志物组合。该组合在血浆中能高准确区分侵袭性垂体腺瘤(IPA)与非侵袭性垂体腺瘤(NPA)(AUC=0.980),为垂体腺瘤的无创早期诊断提供了新策略和理论基础。
垂体腺瘤(PA)是最常见的颅内良性肿瘤之一,但约30-40%的患者存在肿瘤侵袭行为,导致术后复发风险较高,治疗难度大。传统的影像学和组织学手段在术前难以准确区分侵袭性垂体腺瘤(IPA)与非侵袭性垂体腺瘤(NPA),因此亟需稳定且可靠的无创生物标志物。DNA甲基化作为一种重要的表观遗传修饰,与肿瘤的发生与进展密切相关。细胞游离DNA(cfDNA)为肿瘤的无创检测提供了新的可能性。本研究通过大规模RRBS测序和RNA-seq多组学整合,旨在寻找可用于IPA识别及机制研究的关键分子。
本研究纳入了129例样本,包括IPA与NPA患者的肿瘤组织及配对血浆样本,并引入健康人群血浆作为对照。研究团队采用RRBS技术对组织及血浆中的cfDNA进行甲基化检测,并同步开展RNA测序,系统构建了垂体腺瘤从组织到体液的多组学数据库,全面探索DNA甲基化与转录表达之间的关联特征。
本研究通过多组学整合分析,系统揭示了IPA与NPA在DNA甲基化和基因表达层面的关键差异,并成功筛选出MIR4535、SLC8A1-AS1和TTC34三基因作为cfDNA甲基化标志物。该标志物组合不仅能高效区分IPA与NPA(AUC=0.980),还可精准识别NPA与健康个体(AUC=0.990)。这项研究为垂体腺瘤的治疗及其无创诊断提供了新的思路和策略。未来,随着样本分类和数量的完善,结合先进的生物信息学技术和多组学分析,有望进一步深入了解肿瘤特异性的发展过程,从而提升早期检测和治疗策略的有效性。
中国科学院合肥物质院研究员谷红仓、浙江大学第二附属医院吴群和张建民为该论文的并列通讯作者。中国科学院合肥物质院项目副研究员赵宁宁和浙江大学第二附属医院陈一可为该论文的并列第一作者。该项研究得到了国家自然科学基金的支持。
文章链接:https://bmcmedicine.biomedcentral.com/articles/10.1186/s12916-025-04164-1
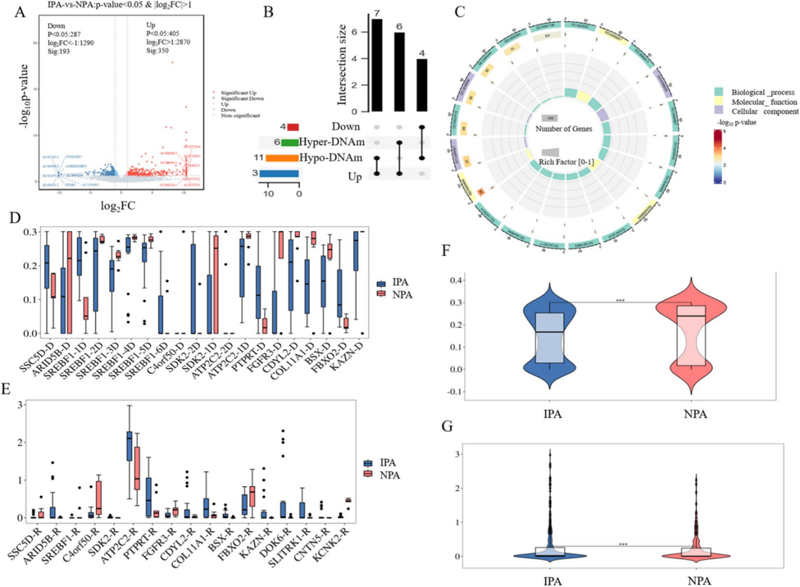
图1 差异甲基化区域与基因表达之间的关联分析
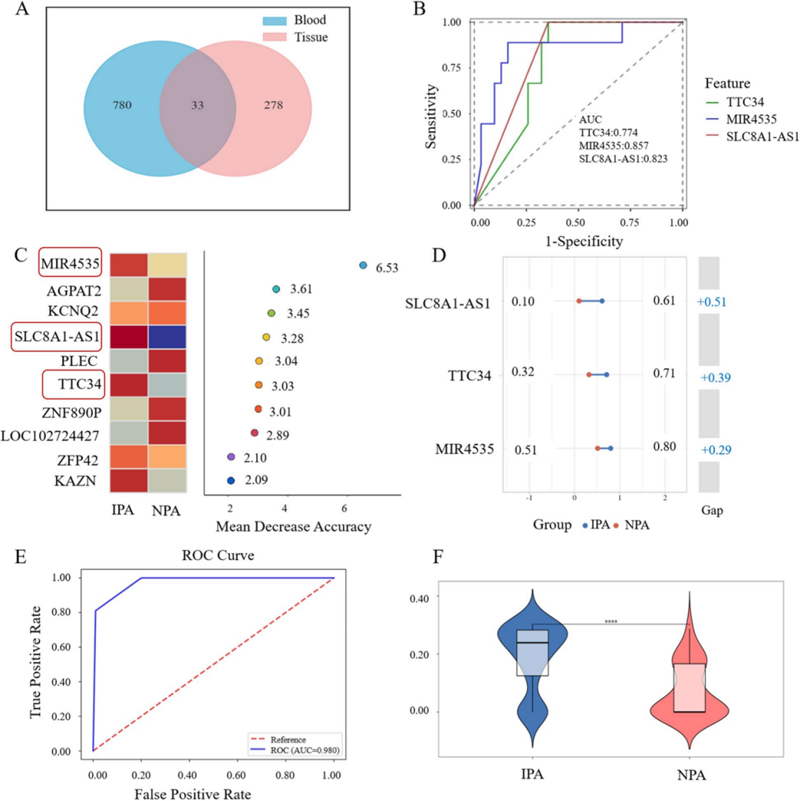
图2 用于从NPA中筛选IPA的cfDNA生物标志物的鉴定











