近日,中国科学院合肥肿瘤医院(中国科学院合肥物质院健康所)杨武林研究员团队在肿瘤治疗领域取得重要进展,揭示肝细胞癌(肝癌)与良性肝再生过程中代谢机制的显著差异,并发现通过联合靶向特定代谢酶与维生素A衍生物,可实现比现有靶向药物更高效的肝癌抑制效果,为肝癌治疗开辟全新路径。该项成果发表于国际著名期刊-国际生物大分子杂志。
肝细胞癌是全球第六大常见癌症,其恶性增殖机制与正常肝组织再生修复过程存在关键差异。传统治疗手段如靶向药索拉非尼虽有一定疗效,但易产生耐药性且副作用明显,急需探索更精准的治疗策略。研究团队通过对比肝癌细胞与良性再生肝细胞的基因表达差异,锁定六个关键代谢酶。这些酶在肝癌中异常活跃,推动癌细胞快速合成生物大分子(如蛋白质、核酸)实现恶性增殖。其中,ATP柠檬酸裂解酶(ACLY)、葡萄糖-6-磷酸脱氢酶(G6PD)、胸苷酸合成酶(TYMS)等三种酶位于代谢通路上游,成为抑制肝癌增殖的“黄金靶点”。与此同时,研究发现肝癌细胞中视黄醇(维生素A)代谢通路受阻,导致其代谢产物视黄酸(RA)水平显著降低。而视黄酸恰好是抑制肿瘤干细胞自我更新的关键因子。基于上述发现,科研人员设计出“代谢酶抑制剂+视黄酸”的联合疗法:通过特异性抑制前述三种代谢酶阻断癌细胞“能量工厂”,同时补充视黄酸抑制肿瘤干细胞再生。实验显示,该组合疗法在体外实验中可显著抑制肝癌细胞增殖,在动物模型中更是展现出比索拉非尼更强的肿瘤抑制效果。
这项发现颠覆了传统单靶点治疗的局限,通过精准打击肝癌代谢网络中的多个关键节点,实现了从‘抑制增殖’到‘阻断再生’的双重打击。该成果不仅为肝癌治疗提供了全新的联合用药策略,也为其他代谢异常相关癌症的研究提供了重要范式。期待后续能快速推进临床研究,使该项联合调控策略快速转化为临床可用的肝癌新疗法,为患者带来更高效、低毒的治疗选择。
该研究获得中国科学院合肥肿瘤医院优青项目资助。
文章链接:https://pubmed.ncbi.nlm.nih.gov/41115561/
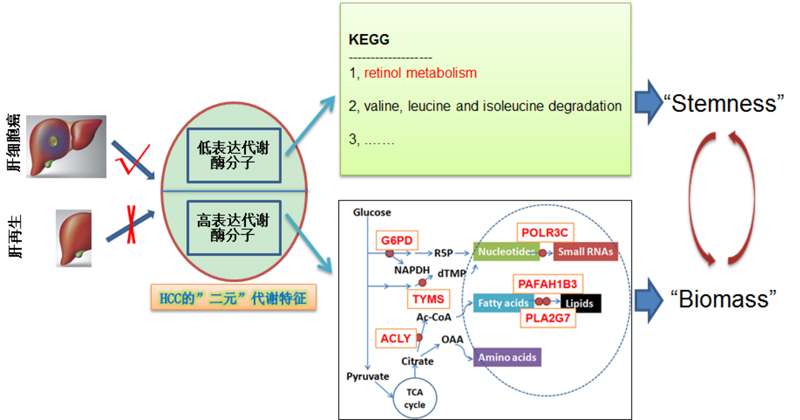
干预靶点调控机制示意图











